EL MOMENTO DIPOLAR
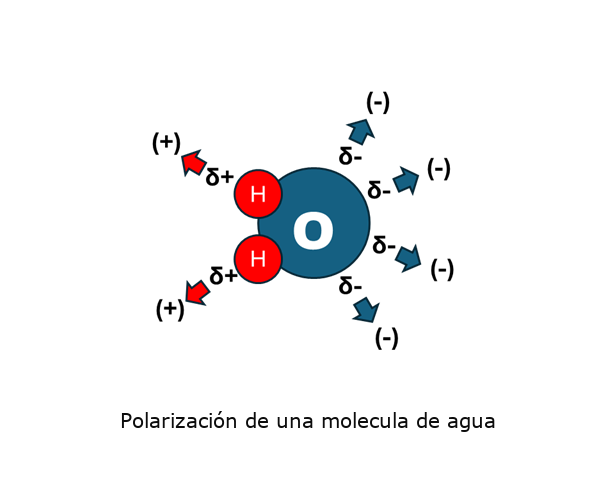
Aunque la espectroscopía infrarroja (IR) es una técnica relativamente sencilla de utilizar, no todas las muestras son aptas para su análisis. Para que una molécula pueda absorber radiación infrarroja, sus enlaces atómicos deben experimentar una variación en su momento dipolar durante la vibración. El momento dipolar es una medida de la polaridad de un enlace químico y depende de la diferencia de electronegatividad entre los átomos que lo conforman. Cuando uno de los átomos es más electronegativo, tiende a atraer con mayor fuerza los electrones compartidos, generando una separación parcial de cargas: una zona más negativa y otra más positiva. Esta separación origina un momento dipolar.
En moléculas que contienen varios átomos distintos (por ejemplo, CO₂, H₂O o CH₃OH), los enlaces presentan distintos momentos dipolares. Estas diferencias permiten que la molécula absorba energía en varias regiones del espectro infrarrojo, ya que distintas vibraciones (estiramientos, flexiones) afectan los dipolos de formas específicas.mDesde el punto de vista físico, el momento dipolar (μ) se define como el producto entre la magnitud de la carga (q) y la distancia que las separa (d), es decir, la longitud del enlace:
μ = q × d
Por tanto, solo las vibraciones moleculares que implican un cambio en el momento dipolar son activas en el infrarrojo. Esta es la razón por la cual algunas moléculas simétricas, como el N₂ o el O₂, no muestran señales en espectros IR: no poseen momento dipolar y, por tanto, no interactúan con esta radiación.